Chimichiamo - La chimica a portata di tutti!
Esperimenti in casa, curiosità e molto altro dal mondo della chimica…
Benvenuti!
Benvenuti in Chimichiamo Blog! Sono un laureato in Chimica Industriale all’Università di Pisa e sono qua per far conoscere meglio a tutti alcuni aspetti della chimica, a mio avviso affascinanti, che riguardano anche la vita di tutti i giorni. Vi illustrerò esperimenti facili da effettuare in casa, cercherò di spiegare in maniera semplificata i meccanismi che ci sono dietro ad ogni fenomeno e magari conosceremo meglio insieme con che tipo sostanze ci troviamo quotidianamente a contatto, i loro usi e le loro peculiarità. Per qualsiasi dubbio o richiesta (anche esercizi!) non esitate a contattarmi per e-mail: [email protected]! Vi risponderò il prima possibile!
Caffeina = Teina: un’identità poco nota
Teina o caffeina? qualche curiosità su una molecola che ha tanti nomi.
Quando sono arrivato all’università ero fermamente convinto che caffeina e teina fossero due cose completamente diverse. Pensavo che fossero due molecole fondamentali nella composizione di caffè e tè rispettivamente.
È vero, al primo anno non sapevo granché di chimica, ma anche quando ho iniziato a masticare qualcosa in più, nella mia ment
e, teina e caffeina erano diventate due molecole distinte, accomunate magari nella struttura da qualche gruppo funzionale identico.
Mi imbarazza ammettere che la realtà dei fatti sono riuscito a scoprirla solo durante un laboratorio didattico: teina e caffeina sono semplicemente sinonimi che indicano la stessa molecola.
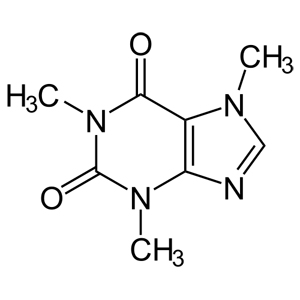
Vengono entrambi utilizzati per identificare quella che, scientificamente parlando, viene chiamata 1,3,7-trimetilxantina o 7-metilteobromina.
Questa sostanza, un alcaloide, non è contenuta soltanto nelle piante di tè e caffè, ma anche in cacao, cola, guaranà… (al solito, Wikipedia fornisce un’ottima descrizione).
In natura questa molecola svolge il ruolo di insetticida, al fine di evitare che le piante vengano attaccate da artropodi vari: sui ragni, ad esempio, ha effetto disorientante ed impedisce loro di poter tessere delle ragnatele che abbiano una solida struttura.
Per l’uomo risulta essere una sostanza psicoattiva, dall’effetto stimolante.
In realtà, tutte le sostanze che fanno parte degli alcaloidi, come ad esempio la morfina, hanno un qualche tipo di effetto farmacologico. Addirittura, l’assunzione di caffeina con frequenza e dosi elevate può risultare in una dipendenza da essa, nota come caffeinismo.
Un aspetto a mio avviso interessante riguardo la caffeina (o teina, che dir si voglia) è rappresentato dal suo percorso metabolico nel nostro corpo. Essa infatti viene in parte trasformata dal fegato in un’altra molecola: la teobromina, nota a molti come la molecola del cioccolato.
La teobromina è infatti un altro alcaloide contenuto in abbondanza nelle piante di cacao, molto simile alla caffeina come struttura.
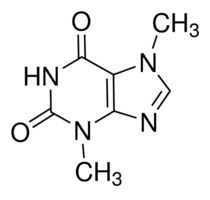
Sul corpo umano agisce da vasodilatatore, oltre che da calmante della tosse, ed amplifica l’effetto stimolante della caffeina.
In un certo senso possiamo affermare che tè, cioccolato e caffè hanno effetti simili sul nostro corpo, dovuti alla presenza di queste sostanze psicoattive. Vale la pena però sottolineare che la concentrazione di queste varia molto a seconda della provenienza ed è abbastanza palese che il caffè rappresenta la fonte più concentrata.
Il limite di tolleranza della caffeina per l’uomo può variare da soggetto a soggetto, ma si può approssimare la dose letale per una persona di 70 Kg a circa 10 g di sostanza, equivalenti all’assunzione di 130 tazzine di caffè espresso o 170 tazze di tè (valore che può variare a seconda del tipo di tè), bevute una di seguito all’altra.
Per concludere, mi ha un po’ rincuorato scoprire che la dimostrazione del fatto che teina e caffeina fossero la stessa molecola è avvenuta solo verso la fine del 1800, grazie agli studi che condussero alla definizione chiara della sua struttura, nonché alla sintesi vera e propria di questa sostanza. Studi che fecero parte dell’assegnazione del premio Nobel per la chimica nel 1902 a Hermann Emil Fischer, un personaggio che chi, come me, ha a che fare con la chimica tutti i giorni, sente nominare piuttosto spesso.
Olio di palma e psicologia del terrore
Mi dispiace, caro Olio di Palma, dopo la Farina “Troppo Raffinata” e la Carne Rossa questa volta è toccato a te. Nel giro di pochi mesi sei diventato portatore sano di morte e distruzione. Senza che cambiasse il modo in cui eri utilizzato o venivi prodotto, ti sei ritrovato esiliato dall’industria alimentare, senza nemmeno che ti pagassero la liquidazione.
So come ti senti.
Ti starai chiedendo: “Perché proprio io? Perché non l’Olio di Semi di Girasole o la Vanillina?”. Visto come vanno le cose, mi viene da risponderti di aspettare, perché prima o poi ci passano tutti…
°°°
Sì, perché è facile trasmettere un’informazione sbagliata alle persone che non hanno le conoscenze adatte per poterla valutare oggettivamente.
Perciò sto scrivendo questo articolo, in un blog che non è sicuramente famoso ma che comunque qualcuno ogni tanto legge, nella speranza di riuscire a contrastare, se pur di pochissimo, quell’enorme piaga della disinformazione online che si espande – è proprio il caso di dirlo – a macchia d’olio.
- Che cos’è l’olio di palma?
- Perché si trova in molti alimenti confezionati?
- Quali sono i suoi effetti sulla salute?
- Che tipo di impatto ambientale provocano le coltivazioni di palma da olio?
Queste le quattro domande più frequenti che ho riscontrato riguardo all’argomento e a cui cercherò di rispondere passo dopo passo.
Ma iniziamo dalle basi:
- Che cos’è l’olio di palma?

L’olio di palma, così come tutti gli oli vegetali, è una miscela di grassi (lipidi, trigliceridi) importanti dal punto di vista nutrizionale purché non se ne ecceda con il consumo (come per ogni altro tipo di alimento).

Lo si ottiene dalla spremitura della polpa del frutto della pianta Elaeis guineensis e non va confuso con l’olio di palmisto, di cui parlerò più avanti, che invece viene ricavato dai semi di questo frutto e che ha caratteristiche molto diverse dall’olio di palma.
Per i metodi di estrazione e purificazione rimando a questa pagina di Wikipedia molto esauriente.

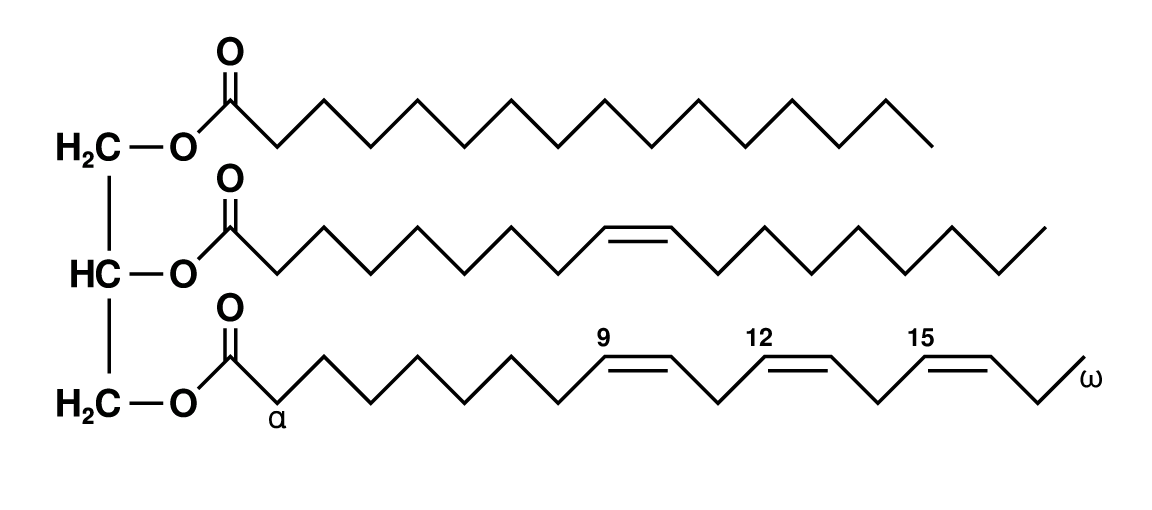
I grassi contenuti in un olio (che possono essere anche di origine animale, come nel burro) sono costituiti da tre catene idrocarburiche più o meno lunghe unite tra loro da un ponte di glicerina tramite legami esterei.
La singola catena con il gruppo carbossilico terminale (-COOH) prende il nome di acido grasso. Gli acidi grassi si dividono in due categorie principali:
- Saturi (a struttura lineare)
- Insaturi (presentano dei doppi legami carbonio-carbonio)
I grassi insaturi, a loro volta, si suddividono in monoinsaturi o polinsaturi a seconda che presentino un solo doppio legame o più di uno.
Acidi grassi diversi hanno effetti diversi sulla salute.
Tenendo a mente questa affermazione, andiamo a vedere più nel dettaglio la composizione tipica dell’olio di palma.
Ricordiamoci che la diversa composizione dei vari oli vegetali è determinata dalla loro provenienza (frutto della palma, cocco, oliva, semi di girasole,ecc.) e solitamente viene espressa in grammi di acidi grassi presenti in 100g di prodotto.
Tipicamente un olio di palma contiene un 50% circa di acidi grassi saturi e un altro 50% circa di insaturi.
L’acido grasso saturo più abbondante nell’olio di palma è l’acido palmitico (16 atomi di carbonio) che è presente in percentuali che variano tra 32-45%; mentre l’acido grasso insaturo maggiormente presente è l’acido oleico (18 atomi di carbonio) al 38-52%.
Quest’ultimo è ben noto, in quanto componente principale (>80%) dell’olio di oliva. Fa parte dei monoinsaturi poiché presenta un solo doppio legame.
Altri acidi grassi che si possono trovare nell’olio di palma sono:
- Acido stearico, saturo a 18 atomi di carbonio, 2-7%
- Acido miristico, saturo a 14 atomi di carbonio, 0.5-2%
- Acido linoleico, polinsaturo a 18 atomi di carbonio (2 doppi legami), 5-11%
- Perché si trova in molti alimenti confezionati?
L’olio di palma è stato, ed è tutt’ora, uno dei pochi sostituti validi del burro ed altri grassi di origine animale contenenti colesterolo ed utilizzabile industrialmente a basso costo.
La sua ricca composizione in acido palmitico (saturo ed in quanto tale a punto di fusione più elevato) lo rende di consistenza simile a quella del burro (solido o semi-solido a temperatura ambiente), caratteristica necessaria nella preparazione di tutti i prodotti da forno, creme e molto altro.
La facilità di coltivazione della palma Elaeis guineensis ed il suo rapido ciclo di crescita e maturazione hanno fatto sì che l’olio così prodotto potesse essere venduto a basso costo.
Il prezzo è poi ulteriormente calato a seguito dell’enorme domanda dei prodotti sopracitati che ha fatto sì che l’utilizzo di quest’olio da parte delle industrie alimentari aumentasse a dismisura.
Prima dell’olio di palma venivano usati altri tipi di oli vegetali resi solidi a temperatura ambiente a seguito di un trattamento chimico chiamato idrogenazione, trattamento che viene effettuato ancora adesso su molti oli per preservarne la qualità ed evitarne l’irrancidimento (degradazione).
La maggior parte degli altri oli, infatti, presenta percentuali più elevate in acidi grassi insaturi (mono- o poli-) i quali tendono più facilmente a degradare per esposizione ad elevate temperature, all’aria, o alla luce per lunghi periodi di tempo.
L’idrogenazione consiste nella trasformazione dei doppi legami presenti negli acidi grassi in legami semplici per inserzione di idrogeno con l’aiuto di un catalizzatore a base di Nichel metallico. Si trasformano quindi i grassi insaturi in grassi saturi e si aumenta il punto di fusione degli oli, che diventano più stabili alle alte temperature e che in alcuni casi diventano solidi, a seconda del grado di idrogenazione (che può essere parziale o totale).
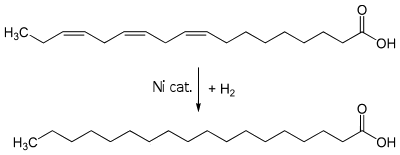
Questo processo porta alla formazione anche di altri prodotti, detti di isomerizzazione degli acidi grassi insaturi, che passano dalla configurazione naturale di tipo cis alla configurazione trans.
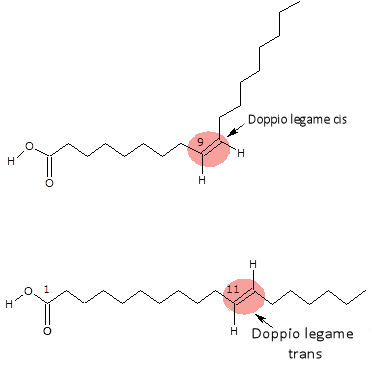
È proprio la formazione di questi prodotti detti acidi trans, che ha portato alla ricerca di un olio che contenesse naturalmente alte percentuali di acidi grassi saturi, senza dover ricorrere all’idrogenazione.
È stata infatti trovata una relazione che lega l’assunzione di acidi grassi trans all’insorgere di malattie coronariche ed aterosclerosi. Come riportato su Wikipedia: “Nel 2002 l’Accademia Nazionale delle Scienze degli Stati Uniti raccomandò la totale eliminazione dalla dieta degli acidi grassi trans.”
Negli USA è infatti obbligatorio indicare sulle etichette la percentuale di acidi grassi trans presenti.
Altro problema derivato dall’idrogenazione è l’incorporazione in quantità minime (ma pur sempre presenti) di residui del catalizzatore a base di Nichel, che purtroppo è uno di quei metalli che provocano fenomeni di sensibilizzazione.
Per intenderci: ne assumete continuamente quantità bassissime e non succede niente, poi raggiunta una certa soglia può scattare la reazione allergica.
Anche alla luce di questo, si capisce il conseguente utilizzo sempre più importante dell’olio di palma.
- Quali sono, quindi, gli effetti dell’olio di palma sulla salute?
Sotto questo aspetto ne ho lette e sentite dire di tutti i colori: l’olio di palma è cancerogeno, fa venire l’infarto, è tossico, contiene metalli pesanti, e così via. La sagra dei luoghi comuni in ambito di tossicità degli alimenti.
La risposta alla domanda è banale, ma deve far riflettere: l’olio di palma, così come ogni altra fonte di grassi, assunto responsabilmente (e non in dosi elevate) non provoca effetti negativi sulla salute. Non fa più male di quanto ne possa fare il burro.
Gli aspetti che devono essere considerati rientrano nella composizione chimica dell’olio vista in precedenza.
Non essendo però un nutrizionista, mi sono documentato ed ho capito che in linea di principio, in una dieta ottimale, bisognerebbe favorire l’assunzione di acidi grassi monoinsaturi a scapito dei polinsaturi e dei saturi, come mostrato in figura.
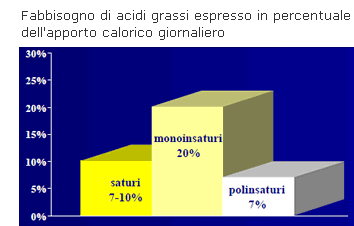
(Non approfondirò oltre gli aspetti nutrizionali poiché non rientrano nel mio ambito di conoscenza, ma chi fosse interessato può leggere questo articolo, a mio avviso molto valido.)
Facciamo quindi un confronto con altri tipi di oli comunemente consumati (per vedere la tabella ingrandita fare click su di essa, si aprirà una nuova scheda):
Le parti evidenziate indicano il componente maggioritario per ogni tipologia di olio (nel caso dell’olio di palma sono due).
Com’è possibile osservare da questo piccolo confronto, le differenze sono molteplici.
L’olio di palma, di cocco e di palmisto presentano una quantità maggiore di grassi saturi: questo però non vuol dire che abbiano le stesse proprietà. Si vede infatti che l’olio di cocco e di palmisto contengono come acidi grassi maggioritari l’acido laurico e l’acido miristico, quest’ultimo è ritenuto essere il maggior responsabile dell’aumento dei livelli di LDL (colesterolo cattivo) nel sangue dovuto all’assunzione di grassi saturi.
Anche l’acido palmitico sembra avere questo tipo di effetto, ma in forza minore.
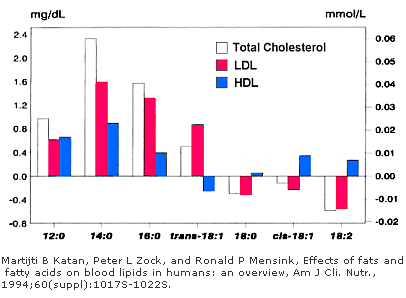
Come riportato nella rewiew da cui è stata presa l’immagine qui sopra, si può notare che tutti gli acidi grassi saturi (laurico, miristico e palmitico ad eccezione dello stearico) e l’acido di tipo trans vanno ad umentare il livello di LDL nel sangue. Tra questi, come già detto, l’acido miristico (14:0) è quello che provoca un effetto maggiore.
Da questa tabella si evince quindi che anche l’acido palmitico ha un effetto negativo in questo senso. Ciò è sicuramente vero, ma non possiamo estrapolare questo dato senza avere una visione d’insieme del problema.
Infatti, a parità di quantità di grassi assunti, un olio di palmisto o un olio di cocco hanno un contenuto in grassi saturi (mirisitco e laurico in maggioranza) nettamente superiore ad un olio di palma, che in pratica ne contiene la metà, il resto è acido oleico (cis-18:1), che invece ha un effetto positivo sui livelli di colesterolo.
Certo è che per assumere gli acidi grassi monoinsaturi, come ci viene consigliato, il migliore olio in assoluto è quello di oliva, con percentuali anche di oltre l’80% di acido oleico, acido che ritroviamo in quantità non indifferenti, oltre che nell’olio di palma, anche nell’olio di soia e in quello di semi di girasole.
In questi ultimi due notiamo la notevole presenza di un altro acido insaturo, l’acido linoleico, che presenta 2 insaturazioni.
Per questi motivi gli oli di semi di girasole e di soia sono sconsigliati, ad esempio, per la frittura, in quanto avendo una maggiore percentuale di acidi grassi insaturi, tendono a decomporre più facilmente alle alte temperature, in tempi più brevi di altri oli.
“Ma quindi l’olio di palma fa male?”
L’olio di palma fa male se non viene assunto in maniera responsabile. Così come ogni altro tipo di olio. L’allarmismo mediatico che ne viene fatto è una cosa che personalmente non concepisco. Molto probabilmente tutti i prodotti, che adesso sponsorizzano il fatto di essere privi di olio di palma, non lo contenevano nemmeno prima che si sollevasse questo polverone. Ma adesso, cavalcano volentieri l’onda del marketing, puntando a far credere al consumatore di vendere prodotti più sani.
In parole povere, è solo uno dei tanti escamotages per sfruttare la questione a scapito del consumatore, che alla fine ci rimette economicamente.
Personalmente dunque non mi preoccupo granché se sulla confezione di ciò che compro trovo scritto “olio di palma”. Mi preoccupo di più se trovo “olio di palmisto” o peggio ancora se trovo “grassi idrogenati”.
In generale comunque limitare l’assunzione di sostanze grasse non può che essere benefico per la salute.
Infine, per mettere in chiaro che questo non è quello che credo io ma si parla di cose oggettive, riporto ciò che è stato pubblicato sul sito del ministero della salute il 25 Febbraio 2016 sulla base di un lavoro dell’Istituto Superiore di Sanità:
“L’Istituto Superiore di Sanità conclude che non ci sono evidenze dirette nella letteratura scientifica che l’olio di palma, come fonte di acidi grassi saturi, abbia un effetto diverso sul rischio cardiovascolare rispetto agli altri grassi con simile composizione percentuale di grassi saturi e mono/poliinsaturi, quali, ad esempio, il burro.”
- L’olio di palma e l’ambiente
Per completare questa rassegna devo spendere due parole anche sull’altro aspetto su cui è stato puntato il dito contro l’olio di palma: la deforestazione incontrollata in Malesia ed Indonesia (leader mondiali nella produzione di questo olio) per far spazio alle coltivazioni dedicate.

Ancora una volta mi trovo a dire che è stato fatto un ingigantimento inutile di ciò che è la realtà attuale. Mi spiego meglio: in passato è vero che si è assistito ad un fenomeno di deforestazione (anche tramite incendi dolosi) non controllata che portava ad un abbattimento dell’habitat di molte specie animali presenti, nonché alla riduzione della superficie verde (ma questo non solo a causa della coltivazione della palma da olio). Adesso però questa deforestazione è strettamente controllata e l’Indonesia ha stretto accordi internazionali per il mantenimento della superficie verde oltre il 50%.
L’Indonesia è un paese economicamente emergente ed in forte espansione grazie anche a queste coltivazioni. Ovviamente questo non vuol dire che le multinazionali non ci guadagnino a comprare la terra in questi paesi a prezzi stracciati, ma ciò non ha certamente niente a che fare con il tipo di coltivazione. Potrebbe essere coltivato anche grano o soia e la situazione sarebbe la medesima.
Tuttavia, il land grabbing, così viene chiamato, è un fenomeno in fase di sviluppo ed in costante crescita, che non posso approfondire ulteriormente data la mia mancanza di basi in materia.
Rimane il fatto che il problema della deforestazione, che porta con sé gravi conseguenze sulla biodiversità, esiste; su questo non ci sono dubbi. Ma è davvero solo colpa delle coltivazioni per la produzione di olio di palma?
Poniamoci i giusti quesiti: se davvero la produzione di olio di palma non è ambientalmente sostenibile, quale altro tipo di produzione di olio vegetale lo è?
E poi, giusto per rimanere in Italia senza dover andare in zone tropicali, pensate che le piante di olivo presenti sul nostro territorio, per produrre più di 3 milioni di tonnellate all’anno di olio di oliva, siano nate spontaneamente? Vi ricordo che siamo il secondo produttore mondiale di questo olio, preceduti solo dalla Spagna.
Pertanto, in definitiva, direi che demonizzare l’olio di palma non ha senso nemmeno sotto questo punto di vista.
- Quali conclusioni?
In conclusione, semplicemente non abbiate timore dell’olio di palma, magari se avete problemi di colesterolo alto state attenti a non assumerne troppo. Ma questa è una considerazione generale, che non vale certo solo per questo olio ingiustamente incriminato.
Mi preme specificare inoltre che questo articolo non è certamente esaustivo e non ha la pretesa di esserlo. Ho solo cercato di riassumere gli aspetti generali della questione, rispondendo in termini un po’ più scientifici ed oggettivi alle domande più comuni a riguardo, per aiutare anche chi non mastica sempre questi argomenti ad avere – spero – le idee più chiare e riuscire così a distinguere chi parla soltanto “per dare aria alla bocca” da coloro che lo fanno con cognizione di causa.
Per finire vorrei che fosse chiaro il messaggio che voglio far passare: l’informazione puntale e ponderata è tutto. Ci si deve documentare, non si deve sentire una sola campana. Si fanno ricerche e ci si fa un’idea più oggettiva della realtà dei fatti.
Non ci si può far prendere per i fondelli dalle attuali pubblicità di ogni casa produttrice di merendine e biscotti che hanno inserito la dicitura: “DA OGGI SENZA OLIO DI PALMA”.
È come prenderci in giro da soli. L’olio di palma è solo l’ennesimo spauracchio su cui speculare. Passata questa fase mediatica in cui chiunque (che sappia o meno qualcosa in merito) deve dire la sua, probabilmente nessuno si ricorderà più del perché l’olio di palma era nell’occhio del ciclone. E andremo avanti così finché non sarà la volta di qualche altro prodotto che prenderà il posto dell’olio di palma e contro cui dovremo puntare il dito per cose le cui cause, magari, dovrebbero essere cercate altrove.
Bibliografia:
- Wikipedia – Olio di Palma, https://it.wikipedia.org/wiki/Olio_di_palma
- Composition and thermal profile of crude palm oil and its products, JAOCS, Vol. 76, no. 2 (1999)
- Wikipedia – Acidi grassi trans, https://it.wikipedia.org/wiki/Acidi_grassi_trans
- http://my-personaltrainer.it/nutrizione/grassi-saturi-insaturi1.html
- http://www.chempro.in/fattyacid.htm
- Katan MB, Zock PL, Mensink RP, Effects of fats and fatty acids on blood lipids in humans: an overview, Am J Clin Nutr. 1994 Dec;60(6 Suppl):1017S-1022S
- Wikipedia – Olea Europaea, https://it.wikipedia.org/wiki/Olea_europaea
Reazione degli scaldamani: il “ghiaccio caldo”
 Ormai in quasi ogni supermercato, specialmente nel periodo invernale e nei reparti “tutto a 1€”, si trovano degli oggetti di varie forme e dimensioni simili a bustine con del liquido all’interno, chiamati scaldamani.
Ormai in quasi ogni supermercato, specialmente nel periodo invernale e nei reparti “tutto a 1€”, si trovano degli oggetti di varie forme e dimensioni simili a bustine con del liquido all’interno, chiamati scaldamani.
Affinché questi oggetti espletino la propria funzione occorre schiacciare un disco metallico presente al loro interno e subito si dà il via ad un meccanismo a catena che porta al solidificarsi della soluzione liquida contenuta e contemporaneamente a sprigionare calore (ecco spiegato il motivo del nome).
L’utilità di questi scaldamani risiede nel fatto che possono essere riutilizzati all’infinito semplicemente immergendoli in acqua bollente dopo l’utilizzo: così facendo il composto all’interno tornerà ad essere liquido.
Ma qual è il meccanismo chimico che sta dietro alla formazione del cosiddetto “ghiaccio caldo” o “hot ice”?
Per prima cosa va precisato che il termine “ghiaccio” è utilizzato impropriamente, anche se ormai di uso comune, poiché si tratta di soluzioni acquose di acetato di sodio, che niente hanno a che vedere con il ghiaccio propriamente detto, ovvero l’acqua allo stato solido.
Questo composto, dal nome apparentemente complesso, fa parte della nostra vita quotidiana in quanto trova utilizzo come conservante all’interno dei cibi: in questo caso prende il nome di diacetato di sodio e viene indicato con la sigla E262.
Dal punto di vista chimico è il sale sodico dell’acido acetico (acido debole) ed in quanto tale, in acqua, è soggetto a idrolisi basica, ovvero le soluzioni di acetato di sodio presentano una leggera basicità. A temperatura ambiente è un solido cristallino dal colore bianco.
L’acetato di sodio (CH3COONa) può essere prodotto per reazione tra acido acetico e bicarbonato di sodio di seguito schematizzata:
CH3COOH + NaHCO3 –> CH3COONa + H2O + CO2
Questa è la tipica reazione tra l’aceto e il bicarbonato di sodio che chiunque abbia giocato al piccolo chimico avrà sicuramente ripetuto in casa, rimanendo sorpreso dalla quantità di schiuma che si formava. Adesso possiamo capirne il motivo: durante la reazione tra i due composti si ha una vigorosa formazione di anidride carbonica (CO2) che, essendo gassosa, risale dalla soluzione provocando l’effervescenza caratteristica.
Quello che però non sapevamo, o almeno di sicuro non sapevo io quando ci giocavo, è che alla fine dell’effervescenza avevamo ottenuto una soluzione di acetato di sodio, il protagonista degli scaldamani.
Il liquido che si trova al loro interno, però, è sì una soluzione di acetato di sodio in acqua, ma particolare: viene definita infatti soluzione supersatura o sovrasatura, vale a dire una soluzione in cui è presente più soluto di quello che in realtà la quantità di acqua presente sarebbe in grado di sciogliere. Questo tipo di soluzioni sono particolarmente instabili ed il soluto in eccesso tende a precipitare o, nel caso dell’acetato di sodio, a dare origine ad un processo di cristallizzazione dell’intero contenuto.
Questo processo è esotermico, in altre parole libera energia sotto forma di calore: infatti schiacciando il disco metallico all’interno dello scaldamani si origina ciò che viene definito centro di nucleazione, che permette la cristallizzazione a cascata dell’intera soluzione, con liberazione di energia.
La particolarità di questo tipo di cristalli così formati (per i più esperti vale la pena dire che sono cristalli triidrati e contengono al loro interno le molecole di acqua facenti da solvente) è che intorno ai 100°C si possono sciogliere nuovamente a dare origine alla soluzione sovrasatura di acetato di sodio in acqua, che potrà così essere utilizzata di nuovo quale coadiuvante nel superare i rigidi inverni. 😉

Di seguito posto un video che ho fatto ormai già da un po’ di tempo (e che potete trovare anche sulla pagina Facebook di Chimichiamo Blog), che riguarda appunto la cristallizzazione di una soluzione supersatura di acetato di sodio che avevo sintetizzato a partire da acido acetico puro e bicarbonato di sodio. In questo caso il processo di cristallizzazione viene avviato dall’aggiunta di un piccolo cristallo preformato di acetato di sodio che funge da germe cristallino.
Adesso quando utilizzerete uno scaldamani saprete qual è il processo chimico che sta dietro a questa sorta di magia… a portata di mano!
Esperimento: candeggina e tintura di iodio
Salve a tutti, purtroppo tentare di portare avanti un blog mentre si cerca di arrivare alla laurea non è così semplice come credevo.
Ma eccomi qua a scrivere di nuovo su qualcosa che spero possa risultare interessante a chi mi segue.
Qualche mese fa una ragazza che segue la pagina Facebook di Chimichiamo Blog mi ha inviato un video di un esperimento trovato su internet e mi chiedeva se sapessi che sostanze venissero utilizzate.
Il video in oggetto lo trovate su You Tube al seguente link. Di seguito invece ne inserisco un altro che si vede meglio:
Nel video il riferimento è puramente di tipo religioso e io voglio prescindere da questo aspetto poiché il mio scopo è solo quello di illustrare come avviene la reazione in oggetto (perché di questo si tratta: una semplice reazione chimica) e fare in modo che possiate provare a rifarla in casa per puro divertimento o effetto scenico, se così vogliamo chiamarlo.
Di video come quello che ho linkato ne esistono tantissimi, e da una breve ricerca ho trovato gli ingredienti adatti:
– Acqua,
– Tintura di iodio,
– Candeggina.
Facendo riferimento al video, più precisamente abbiamo acqua nel bicchiere con la scritta “YOU”, candeggina nel bicchiere con la scritta “CHRIST” e infine tintura di iodio nel bicchiere con scritto “SIN”.

La tintura di iodio viene utilizzata come disinfettante e si trova facilmente in farmacia o nei supermercati. La candeggina, allo stesso modo, è facilmente reperibile in qualsiasi supermercato nel reparto dei prodotti per la pulizia.

Versando la tintura di iodio all’interno del bicchiere con l’acqua si ottiene la semplice colorazione di quest’ultima, con la formazione di una soluzione di iodio più diluita, ma pur sempre colorata.
Lo iodio elementare, I2, non è molto solubile in acqua e tende a sublimare (a passare cioè dallo stato solido direttamente a quello gassoso) e per facilitarne la solubilità viene utilizzato ioduro di potassio, KI, che è estremamente solubile e dà origine a ioni K+ e I–.
La tintura di iodio è infatti una soluzione di iodio (I2) e ioduro di potassio (KI) in acqua ed etanolo. L’equilibrio che comporta la solubilizzazione dello iodio è il seguente:
I2 + I– –> I3–
Dove I2 è lo iodio elementare e I– è lo ione ioduro derivante da KI. Il prodotto di questa reazione prende il nome di ione triioduro ed è questo a dare alla soluzione la tipica colorazione bruna.
Lo ione triioduro, a livello di reattività chimica, è comunque paragonabile a I2 e quindi viene considerato la forma idrosolubile dello iodio elementare.
Quindi la tintura di iodio aggiunta all’acqua la colora semplicemente.
Ma cosa accade quando si portano a contatto la tintura di iodio e la candeggina?
Come ho già spiegato in un precedente articolo in cui parlavo della candeggina (NaOCl, ipoclorito di sodio), questa è una soluzione basica, dovuta all’idrolisi prodotta dalla base coniugata dell’acido debole HClO (acido ipocloroso).
ClO– + H2O –> HClO + OH–
In ambiente basico (presenza di ioni OH–) accade che lo iodio presente come I2 viene convertito in acido ipoiodoso (HIO) e quest’ultimo, essendo instabile, si converte a sua volta in iodato (IO3–). Ecco una schema delle reazioni:
I2 + OH– –> HIO + I–
3HIO + 3OH– –> IO3– + 2I– + 3H2O
I prodotti di queste reazioni sono incolori e quindi fanno sì che mettendo a contatto la candeggina con la tintura di iodio la soluzione diventi trasparente.
 Ecco spiegato come il liquido contenuto all’interno del bicchiere con la scritta CHRIST non si colori all’aggiunta della tintura di iodio.
Ecco spiegato come il liquido contenuto all’interno del bicchiere con la scritta CHRIST non si colori all’aggiunta della tintura di iodio.
A questo punto avete capito il trucco: versate della candeggina dove c’è la tintura di iodio e questa perderà la sua colorazione.
Adesso potete divertirvi a riproporre questo esperimento come meglio credete, a sfondo religioso o meno, purché vi divertiate!
I tipi di plastica che possono andare in lavastoviglie
 Bottiglie, bicchieri, piatti, contenitori per i cibi, posate e chi più ne ha più ne metta! Ormai la plastica copre una grossa percentuale di tutti gli utensili più utilizzati!
Bottiglie, bicchieri, piatti, contenitori per i cibi, posate e chi più ne ha più ne metta! Ormai la plastica copre una grossa percentuale di tutti gli utensili più utilizzati!
A basso costo e riciclabile se si smaltisce in modo corretto, come previsto dai propri comuni di residenza, la plastica è una nostra compagna quotidiana senza la quale avremmo grossi problemi!
Il dibattito sul fatto che questa comporti gravi danni ambientali a causa della sua non biodegradabilità è sempre più acceso e quantomai aperto, ma il problema si pone dal momento che la popolazione non ne fa un uso corretto.
La mia attenzione però si sposta su un problema meno grave ma comunque sempre presente nella nostra vita quotidiana, su una domanda in particolare che ognuno di noi si sarà posto almeno una volta: “ma questo oggetto può andare in lavastoviglie?”.
Occorre precisare che esistono svariati tipi di plastica, si parla infatti, più precisamente, di materie plastiche: materiali formati da polimeri (grosse molecole a catena molto lunga) di varia natura, che possono essere puri oppure miscelati tra di loro, con l’aggiunta di additivi vari per ottimizzarne le caratteristiche in base alla funzione che dovranno svolgere.
Ma quali sono i tipi di plastica che possiamo lavare in lavastoviglie?
Occorre precisare che i danni che possono riportare le materie plastiche a causa di un lavaggio in lavastoviglie sono da imputare esclusivamente alla temperatura alla quale avviene questo processo.
Alcune plastiche possono tranquillamente resistere a temperature di 100°C e oltre.
Altre invece iniziano a deformarsi a temperature decisamente inferiori. Temperature che, in effetti, possono essere raggiunte tranquillamente dall’acqua di lavaggio della lavastoviglie a seconda del tipo di programma impostato.
Riconoscendo quindi il tipo di plastica con cui abbiamo a che fare possiamo sapere se questa è adatta o meno alla lavastoviglie.
Iniziamo con l’imparare a conoscere i vari tipi di plastica.
Per sapere di che tipo di materiale plastico è fatto l’oggetto in questione occorre controllare su di esso i simboli riportati. Di seguito una tabella delle varie possibilità:
| Simbolo | Nome |
| PET, Polietilentereftalato | |
| HDPE, Polietilene ad alta denistà | |
| PVC, Polivinil cloruro | |
| LDPE, Polietilene a bassa densità | |
| PP, Polipropilene | |
| PS, Polistirene | |
| O, Altre materie plastiche |
Questi sono i vari simboli che classificano le materie plastiche in generale.
C’è da dire che il PVC non viene mai usato per il contatto con gli alimenti e per questo motivo non sarà nostro interesse lavarlo in lavastoviglie. Così come il polietilene a bassa densità, LDPE, che invece viene usato per gli imballaggi e per i sacchi dell’immondizia.
Un’altra osservazione è che con l’ultimo simbolo si indicano le altre materie plastiche tra cui il polimetilmetacrilato (plexiglas) e il policarbonato (si trova anche indicato con PC) di cui solo quest’ultimo trova qualche sporadico utilizzo in ambito casalingo.

Quello che comunque risulta essere importante per il nostro scopo è il fatto che tutte le altre materie plastiche riportate sopra (compreso il policarbonato), tranne una, possono essere lavate in lavastoviglie con qualsiasi programma di temperatura senza che si deformino, poiché l’acqua di lavaggio non può raggiungere temperature sufficientemente alte.
L’unico tipo di plastica che non può essere lavato in lavastoviglie se non con programmi impostati che non superino i 50°C è il PET, la plastica di cui normalmente sono fatte le bottiglie dell’acqua. Quel tipo di plastica è infatti pensato per un singolo utilizzo e il materiale da cui è composto inizia a deformarsi già intorno ai 60°C.
Se avete dubbi o perplessità a riguardo dell’argomento non esitate a commentare o a scrivermi personalmente!
I rischi domestici: mescolare la candeggina con altri prodotti
Eccoci di nuovo a parlare insieme di chimica quotidiana dopo la pausa a causa dello studio! Oggi ci soffermiamo su quelli che possono essere alcuni dei rischi che corriamo nelle nostre case quando si ha a che fare con i prodotti per la pulizia; in particolar modo parleremo della candeggina e dei suoi effetti se mescolata con le sostanze sbagliate.
È d’obbligo in questa sede ricordare che occorre prestare solo un po’ di attenzione in più e fare le cose con la dovuta accuratezza: quando acquistiamo un qualunque prodotto per la pulizia dobbiamo sempre leggere le indicazioni ed imparare a conoscere i simboli di rischio sopra riportati (ma di questo parleremo meglio in un altro articolo).
Torniamo sulla ben nota candeggina, prodotto che viene utilizzato in tutte le case e per svariati scopi: dalla sua capacità sbiancante, al suo effetto disinfettante, per la pulizia e l’igiene dei pavimenti o per lavare biancheria in generale. Il prodotto che tutti noi utilizziamo è una soluzione non troppo concentrata (solitamente meno del 5%) di ipoclorito di sodio (NaClO), il sale sodico derivato dall’acido ipocloroso (HClO), in aggiunta con tensioattivi e profumi vari. È un composto piuttosto basico (vedi articolo sui test del pH) e ciò è dovuto al fatto che in acqua si dissocia in ioni Na+ e ClO–, quest’ultimo (tecnicamente definito come base coniugata dell’acido debole HClO) instaura in acqua un equilibrio che porta ad un aumento di ioni OH– in soluzione, rendendola basica:
ClO– + H2O –> HClO + OH–
La candeggina presenta dei rischi già così com’è: è leggermente corrosiva e irritante e quindi deve essere sempre maneggiata con le dovute precauzioni (come ad esempio i guanti).
In chimica, quando si parla di rischi legati ad un composto, un aspetto importante da tenere sempre presente è la sua concentrazione in soluzione; l’ipoclorito di sodio è anche alla base di un altro prodotto che conosciamo tutti benissimo: l’Amuchina. In questo caso la sua concentrazione è molto ridotta rispetto a quella che ha nella candeggina, questo per far sì che esplichi la sua funzione disinfettante senza però arrecare altri tipi di danni.
Mi sono però prefisso di scrivere in questo articolo quali sono i rischi correlati all’incompatibilità della candeggina con altre sostanze.
Esaminiamoli alcuni.
Candeggina + Ammoniaca: sì o no?
NO.
Non è buona norma mescolare candeggina e ammoniaca poiché l’ipoclorito tende a reagire con l’ammoniaca (NH3) formando dei composti irritanti, dall’odore pungente, chiamati clorammine (la monoclorammina ha formula NH2Cl). In questo caso non si ha sviluppo di gas tossici ma bisogna comunque stare attenti che questi prodotti non vengano in contatto in ambito casalingo.
Candeggina + Acqua Ossigenata: sì o no?
Sì.
Non ci sono rischi nel mescolare la candeggina con l’acqua ossigenata (H2O2), anzi, la reazione tra i due composti libera ossigeno gassoso ed è quindi anche carina da osservare grazie all’effervescenza che produce. (Presto pubblicherò un simpatico esperimento a riguardo.) Ecco la reazione schematizzata:
NaClO + H2O2 –> NaCl + H2O + O2
Candeggina + Acido Muriatico: sì o no?
Assolutamente NO.
La cosa più pericolosa che si può fare è mescolare l’acido cloridrico (noto anche come acido muriatico) con la candeggina. Uno dei prodotti della reazione che avviene tra i due composti è cloro gassoso (Cl2), estremamente tossico se inalato. Ad elevate concentrazioni può portare addirittura alla morte.
NaOCl + 2HCl –> NaCl + Cl2 + H2O
Quindi MAI mescolare candeggina e acido muriatico, nonostante siano entrambi prodotti utilizzati per la pulizia.
Candeggina + Alcool Etilico: sì o no?
No.
I prodotti che possono venire fuori dalla reazione tra alcool etilico (o etanolo, C2H5OH) e candeggina sono di svariata natura e dipendono molto dalle condizioni in cui avviene la reazione e dalle proporzioni dei due reagenti. Principalmente l’ipoclorito ha un’azione ossidante nei confronti dell’alcool che viene convertito nella corrispondente aldeide (acetaldeide) e questa a sua volta viene ossidata ad acido acetico che, in soluzione, è presente come acetato di sodio (che non presenta particolari rischi, viene utilizzato anche come conservante). Altri prodotti della reazione possono essere quelli che fanno parte della famiglia dei composti organici clorurati, che invece hanno quasi sempre effetti negativi sulla salute; uno di questi prodotti potrebbe anche essere il cloroformio (CHCl3). Non si può però prevedere con assoluta certezza quali di questi prodotti possano formarsi e soprattutto non si possono conoscere le percentuali relative di ognuno. Proprio per questi motivi si sconsiglia di mescolare candeggina ed alcool etilico.
Ovviamente questa è solo una piccola rassegna assolutamente non esaustiva di quelle che possono essere tutte le reazioni che possono avvenire con la candeggina. Ho cercato di mettere quelle che più si avvicinano alla quotidianità, considerando prodotti che possiamo trovare nella maggior parte delle case. Inoltre non mi sono soffermato molto sui vari tipi di reazione dal punto di vista prettamente chimico: questo perché l’articolo vuole essere quanto più chiaro possibile anche a chi di chimica non sa molto. Se per caso aveste bisogno di ulteriori informazioni o delucidazioni a riguardo potete contattarmi all’indirizzo [email protected]
Esperimento: test fai da te sul pH (parte 2)
Nel precedente articolo avevo accennato ai test sul pH fatti utilizzando indicatori naturali ricavati dai fiori. Oggi vediamo come effettuare questo secondo test fai da te sul pH!
I pigmenti contenuti nei fiori di molte piante sono dei composti che cambiano il colore a seconda dell’ambiente in cui si trovano, ovvero sono degli indicatori naturali di acidità. Un esempio piuttosto comune è quello dei fiori dell’ortensia che possono essere rossi o blu a seconda del tipo di terreno su cui crescono! Addirittura una stessa pianta può far sbocciare fiori rossi e blu contemporaneamente se cresce su un terreno che presenta zone con acidità diversa.
Di indicatori naturali, come già detto varie volte, ne esistono moltissimi, io mi limiterò a farvi vedere quello che ho fatto con due dei fiori più comuni: la rosa rossa, e il geranio rosso. Voi potete sbizzarrirvi con tanti altri tipi di fiori o piante che vi elencherò alla fine dell’articolo.
Materiale occorrente:
- un petalo di rosa rossa (oppure alcuni petali di geranio rosso);
- un bicchiere di vetro;
- un pentolino;
- acqua, 100mL (al solito sarebbe sempre meglio se è demineralizzata);
- alcuni bicchierini trasparenti.


< Rosa
Geranio >
La prima cosa da fare è estrarre il pigmento indicatore dal petalo che abbiamo.
Per fare questo esistono vari metodi: si può usare acqua calda che porti in soluzione il pigmento (grazie anche ad una buona azione meccanica di pressatura e frantumazione del petalo) oppure si può estrarre con alcool etilico, che solubilizza efficacemente il pigmento. Personalmente ho svolto l’esperienza con acqua perché ero a corto di alcool e anche perché l’acool etilico denaturato ha già al suo interno quel tipico colorante rosa che ci infastidisce un po’ per lo scopo del nostro test sul pH (andiamo infatti a vedere delle variazioni di colore, quindi è meglio se il solvente è trasparente).
Prendete il petalo e fatelo a pezzetti piccoli all’interno del bicchiere, nel frattempo mettete l’acqua a scaldare all’interno del pentolino (non importa che raggiunga l’ebollizione).



Mettete poi l’acqua calda all’interno del bicchiere con i pezzetti di petalo e, con l’aiuto di un cucchiaino, iniziate a schiacciare bene tutti i pezzi; continuate a girare bene il tutto finché non vi accorgerete che l’acqua nel bicchiere avrà assunto una colorazione bluastra o violacea, a seconda che si tratti rispettivamente del petalo della rosa o del geranio.
A questo punto potete trasferire il liquido colorato ottenuto all’interno dei vari bicchierini a piccole dosi (il numero dei bicchierini dipende da quante prove volete fare).
Nella mia esperienza ho utilizzato ogni volta 10mL di liquido (prelevati con una siringa).
Abbiamo così ottenuto il nostro indicatore di acidità!
Nel resto dell’esperienza potete dare sfogo alla fantasia: potete fare prove con tutto ciò che vi viene in mente, dovete soltanto inserire poche gocce della soluzione di cui volete conoscere il pH all’interno del bicchierino!
Personalmente ho fatto 3 prove diverse con:
– aceto;
– bicarbonato di sodio;
– candeggina.
Per l’aceto e la candeggina ho aggiunto direttamente al bicchierino poche gocce dei due liquidi in due diversi bicchierini; per il bicarbonato, invece, basta che ne mettiate alcuni granelli all’interno del bicchierino con il liquido indicatore e mescoliate bene il tutto.
Ecco i risultati ottenuti:
1. Liquido indicatore ottenuto dal petalo di rosa rossa

2. Liquido indicatore ottenuto dai petali di geranio rosso

Dai risultati ottenuti possiamo vedere come i due indicatori passino da un colore rosso in presenza di sostanze acide (aceto) ad un colore giallo in presenza di sostanze basiche (candeggina), passando attraverso un blu più acceso in presenza di sostanze basiche più deboli (bicarbonato).
Come conclusione possiamo affermare che abbiamo ottenuto due ottimi indicatori di pH da dei comuni fiori da giardino.
Adesso potete conoscere l’acidità o la basicità di una sostanza anche a casa vostra grazie a questo semplice esperimento!
Come dicevo poco sopra, potete utilizzare anche altre piante oltre alla rosa rossa o il geranio rosso: potete provare a vedere cosa succede con la rosa bianca, con le foglie di cavolo rosso, oppure con le bacche di vite americana, oppure ancora con le bacche di biancospino… Provate ad estrarre gli indicatori da questi elementi che vi ho citato seguendo il meccanismo sopra descritto o meglio facendo bollire le bacche o le foglie di cavolo rosso e fatemi vedere i vostri risultati!
Potete anche inserire le vostre foto nella pagina dedicata, cliccando qui!
Buon lavoro!
Esperimento: test fai da te sul pH
Nel precedente articolo abbiamo parlato di cosa sia il pH, oggi vi mostrerò come poter effettuare un test di pH con ciò che abbiamo nelle nostre case.
Come avevo già accennato in precedenza, esistono dei metodi meno precisi dei pH-metri che consentono comunque il riconoscimento di sostanze acide o basiche attraverso l’uso degli indicatori

Gli indicatori sono delle specie chimiche che hanno la peculiarità di variare il proprio colore a seconda dell’ambiente in cui si trovano: acido, basico o neutro. In natura ce ne sono moltissimi di questi indicatori e vengono scelti a seconda dei loro intervalli di viraggio, ovvero a seconda dei valori di pH ai quali assumono colorazioni diverse.
Uno di questi indicatori naturali viene usato di continuo da tutti noi: il tè.
Chi ama aggiungere un po’ di limone al tè avrà sicuramente assistito alla sua caratteristica di indicatore naturale: il succo di limone è infatti acido e quando viene a contatto con il tè, questo assume una colorazione più chiara poiché il pH si è abbassato.
Ma vediamo adesso come condurre al meglio la nostra esperienza.
Per prima cosa ecco l’occorrente:
- un pentolino;
- acqua;
- una bustina di tè;
- un cucchiaino;
- un bicchiere (di vetro o di plastica, basta che sia trasparente);
- succo di limone
Prendete il pentolino e mettete a scaldare l’acqua come fate normalmente per prepararvi il tè. Una volta giunta all’ebollizione spegnete il fuoco e mettete in fusione la bustina di tè.
(Visto che per l’esperimento non ne servirà tantissimo potete approfittarne per fare merenda!)
Lasciatene comunque un po’ da parte e mettetelo a raffreddare. Quando avrà raggiunto la temperatura ambiente possiamo iniziare con le nostre prove.
Prendete il bicchiere trasparente e versateci all’interno parte del vostro tè. La quantità non è importantissima ma basta che si veda il colore: tanto per capirci basta che il livello del liquido sia almeno di 1cm dal fondo.
Prendete adesso il succo di limone e fate delle aggiunte graduali di qualche goccia: man mano che aggiungete il succo mescolate bene con il cucchiaino e vedrete che gradualmente il tè inizierà a diventare sempre più chiaro.

Nell’immagine si nota piuttosto bene il cambiamento di colore: 1 = tè senza alcuna aggiunta; 2 = tè con qualche goccia di succo di limone; 3 = tè con un cucchiaino pieno di succo di limone.
Si può osservare come, all’aumentare della quantità di succo aggiunto (e quindi al diminuire del pH), il colore diventi sempre più chiaro. Come già spiegato, questo fatto dipende dalla caratteristica di indicatore che ha il tè.
Ma se in presenza di sostanze acide il tè diventa più chiaro, a contatto con sostanze basiche cosa può accadere? Scopriamolo insieme!
L’esperimento con sostanze basiche può essere condotto esattamente come il precedente, con la sola differenza che al posto del succo di limone dovremo usare qualcosa che aumenti il pH della soluzione, come ad esempio ammoniaca, bicarbonato di sodio, candeggina…
Personalmente ho fatto soltanto due prove diverse con quello che avevo a disposizione, ma voi potete sbizzarrirvi come preferite!
Vi riporto qua i miei due esempi:
Tè + Amuchina (soluzione acquosa di NaOCl)
La prima immagine è quella senza aggiunte, le altre due rappresentano le aggiunte successive.
Si può notare che in effetti c’è un leggero cambiamento di colore, il tè tende a diventare più scuro, al contrario di quello che accadeva con il succo di limone.
L’Amuchina in effetti è una sostanza leggermente basica, anche se non troppo.
Tè + Soda Caustica (NaOH)
Per vedere se effettivamente le basi avessero l’effetto di rendere il tè più scuro ho utilizzato un po’ di soda caustica (ATTENZIONE! E’ ESTREMAMENTE CORROSIVA!), che avevo a disposizione.

Come ci aspettavamo, in questo caso l’effetto della base forte è decisamente più marcato. Il tè assume una colorazione fortemente più scura a causa dell’innalzamento brusco di pH.
Come conclusione possiamo affermare che il tè risulta essere un buon indicatore naturale di acidi e basi. Abbiamo visto come in presenza di acidi assuma colorazioni più chiare, mentre in presenza di basi diventi più scuro.
Adesso potete davvero divertirvi a sperimentare che tipi di sostanze avete in casa: potete provare con l’aceto, con il bicarbonato di sodio… e scoprire così se sono sostanze acide o basiche.
Il tè non è però l’unico indicatore naturale che possiamo avere nelle nostre case. Nel prossimo articolo trovate come effettuare misure di pH ricavando indicatori naturali dai fiori più comuni.
Acidi e basi: cos’è il pH?

Spesso, nella vita di tutti i giorni, sentiamo parlare di acidi e basi o misure di pH.
Ma cosa si intende con queste espressioni?
Sicuramente la maggior parte delle persone sanno dare degli esempi di sostanze acide; un po’ meno invece, sono quelle che sanno fornire nomi di sostanze basiche. Questo perché, in effetti, nella vita quotidiana ci troviamo molto più spesso di fronte a sostanze dalle caratteristiche acide: succo di limone, aceto, acido muriatico… Con le sostanze basiche abbiamo a che fare allo stesso modo ma in ambiti diversi poiché, in linea di massima, nessuna sostanza basica è commestibile. Trovano il loro impiego principale come prodotti per la pulizia come ad esempio l’ammoniaca e la soda caustica.
Sono molte le definizioni che si possono trovare di acidi e basi, la più semplice, che riguarda solo una piccola parte delle sostanze che però sono quelle che a noi interessano di più, afferma che:
-le sostanze acide sono quelle sostanze che in acqua fanno aumentare la concentrazione degli ioni H+;
-le sostanze basiche sono quelle sostanze che in acqua fanno aumentare la concentrazione degli ioni OH–
Questa in realtà non è una definizione accurata ma ci aiuta a capire meglio e in maniera semplice cosa sono e a cosa servono le misure del pH.
Il pH è una grandezza che misura il livello di concentrazione degli ioni H+ in soluzione acquosa. Matematicamente parlando il pH è esprimibile come l’opposto del logaritmo della concentrazione degli ioni H+ (indicata con [H+] ) :
pH = -log[H+]
Le sostanze acide in acqua fanno aumentare il valore [H+], di conseguenza il valore di pH diminuirà.
Le sostanze basiche fanno aumentare il valore di [OH–], che significa diminuire il valore di [H+], poiché esiste una precisa correlazione tra la concentrazione dei due ioni in acqua (se uno aumenta, l’altro diminuisce e viceversa). Ciò significa che fanno aumentare il valore di pH.
Il pH rientra in una scala di valori che vanno da 0 a 14.
Si definisce acida una soluzione il cui valore di pH risulta essere minore di 7; al contrario una soluzione basica avrà un pH>7.
Una soluzione il cui pH risulta essere uguale a 7 viene detta neutra (acqua demineralizzata a 25°C).

Conoscere il pH di una soluzione è estremamente importante, anche solo ad esempio per avere un’idea sulla pericolosità di ciò con cui stiamo lavorando: pH molto elevati (tipici di basi forti concentrate) o molto bassi (tipici di acidi forti concentrati) conferiscono alla soluzione caratteristiche corrosive!
Esistono molti metodi di misura del pH: alcuni molto precisi e che utilizzano strumenti che forniscono il valore esatto (pH-metri), altri più “alla mano”, che sfruttano i cosiddetti indicatori, ma che sono comunque di largo utilizzo poiché quello che risulta essere importante nella vita di tutti i giorni non è tanto il valore preciso del pH, quanto piuttosto sapere più semplicemente che definizione dare a una soluzione: acida, basica o neutra.
Sarà proprio di questi metodi più “alla mano” che parleremo nei prossimi articoli e su cui potremo fare le nostre esperienze su acidi e basi che conosciamo molto bene.
Piccola curiosità sui bicchieri di plastica!
Volete sorprendere i vostri amici e conoscenti con un semplice trucchetto sui bicchieri di plastica? Allora leggete qua!
 Fatevi dare un bicchiere di plastica che voi non avete mai visto.
Fatevi dare un bicchiere di plastica che voi non avete mai visto.
Prendetelo in mano senza guardare il fondo e schiacciate i bordi fino a farli toccare: se si rompe potrete affermare con sicurezza che sul fondo ci sarà scritto PS oppure il numero 6, in caso contrario troverete la scritta PP o il numero 5.

PS e PP sono le abbreviazioni di Polistirene (detto anche Polistirolo) e Polipropilene, due polimeri largamente utilizzati industrialmente che nonostante possano sembrare simili, presentano proprietà totalmente diverse! Il polistirene è un polimero dalle caratteristiche simili al vetro e risulta infatti più fragile (il bicchierino si rompe); il polipropilene invece può essere deformato senza presentare fratture poiché presenta un comportamento più “elastico”.
Fatemi sapere se il trucco ha funzionato!





